Nueva estrategia experimental para abordar la cicatrización y la fibrosis
En la parte exterior del cuerpo, las cicatrices suelen estar debajo de la capa externa de la piel. Dado que la mayoría de las cremas tópicas no pueden penetrar lo suficientemente profundo como para llegar a las áreas afectadas de manera efectiva, hay pocas maneras de remodelar o curar el tejido.
Dentro del cuerpo, las cicatrices y la fibrosis pueden afectar a muchos tejidos y órganos diferentes, cada uno con su entorno y desafíos únicos, siendo la cirugía la principal opción de tratamiento en ambos casos.
Los experimentos con células humanas derivadas de pacientes y modelos animales muestran que la estrategia es efectiva, no tóxica y sus efectos reversibles
Un equipo del Centro de Regulación Genómica de Barcelona (CRG) y de la Universidad de Colonia (Alemania) ha desarrollado una nueva estrategia experimental para abordar la cicatrización y la fibrosis, entendida como el desarrollo en exceso de tejido conectivo fibroso en un órgano o tejido como consecuencia de un proceso reparativo o reactivo.
Los experimentos con células humanas derivadas de pacientes y modelos animales muestran que la estrategia es efectiva, no tóxica y sus efectos reversibles. Los hallazgos se publican hoy en la revista Nature Communications.
La cicatrización se produce a partir de la secreción y acumulación de varios componentes, principalmente las proteínas conocidas como colágenos, en el espacio entre las células individuales. Esta reacción ocurre como respuesta a una lesión o daño.
La secreción excesiva de colágeno también puede causar la acumulación de tejido fibrótico, una condición grave en la que se forma un exceso de tejido conectivo hasta el punto de comprometer la función de los tejidos y, a veces, de órganos enteros. Alrededor del 45 % de las muertes en el mundo industrializado se atribuyen a alguna forma de fibrosis tisular.
Los tratamientos actuales suelen ser ineficaces porque no logran eliminar el exceso de colágeno. Aquí intentamos una idea completamente diferente: reducir la exportación de este a nivel celular
Vivek Malhotra (CRG)
“Los tratamientos actuales suelen ser ineficaces porque no logran eliminar el exceso de colágeno. Aquí intentamos una idea completamente diferente: reducir la exportación de este a nivel celular, liberando suficientes proteínas para que los tejidos no se desmoronen y evitar la acumulación de cantidades excesivas que perjudiquen su función”, explica Vivek Malhotra, coautor principal del estudio e investigador del CRG.
IA para optimizar las terapias
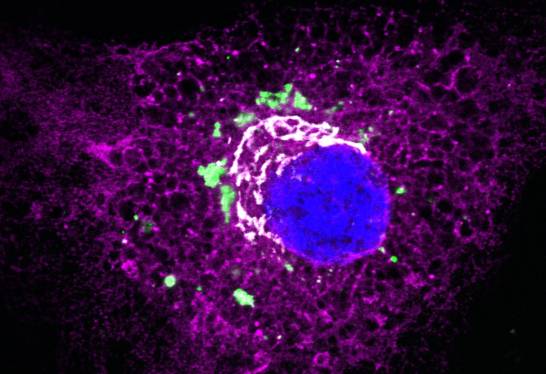
La nueva estrategia consiste en utilizar moléculas pequeñas (péptidos) para interrumpir la interacción entre las proteínas TANGO1 y cTAGE5. Ambas trabajan juntas para exportar colágenos hacia el exterior de la célula. Las dos proteínas ‘se asientan’ en el punto de salida del retículo endoplásmico, un lugar donde los materiales como las proteínas se empaquetan y se transportan fuera de la célula.
“El punto de salida del retículo endoplásmico se ha considerado siempre una diana terapéutica inabordable porque un tercio de todas las proteínas humanas lo atraviesan. Por este motivo, inhibir su actividad probablemente tendría muchos efectos secundarios”, afirma Ishier Raote, primer autor del estudio.
“Sin embargo, se ha demostrado recientemente que existe cierta especificidad para los materiales secretores, y el objetivo ha sido conseguir una precisión dirigida para lograr esta especificad inhibiendo la unión entre TANGO1 y cTAGE5”, añade.
La nueva estrategia consiste en utilizar péptidos para interrumpir la interacción entre TANGO1 y cTAGE5, proteínas que trabajan juntas para exportar colágenos hacia el exterior de la célula
Las proteínas son como piezas de un rompecabezas. Para saber cómo encajan dos piezas, es necesario ver claramente su estructura. Tanto TANGO1 como cTAGE5 son proteínas grandes y complejas que cambian de forma constantemente. Hasta la fecha, la estructura exacta de cada proteína sigue siendo desconocida, dificultando los esfuerzos para diseñar fármacos que puedan bloquear la interacción.
El equipo científico superó este desafío mediante el uso de AlphaFold2, un programa de inteligencia artificial que puede adivinar las estructuras de ambas proteínas. Las predicciones realizadas por la IA permitieron a los autores diseñar péptidos que pueden atravesar una membrana celular e interrumpir la interacción entre TANGO1 y cTAGE5.
Los péptidos se probaron en fibroblastos humanos normales, un tipo de célula común del tejido conectivo. Estos inhibieron con éxito la exportación de colágeno, haciendo que se acumulara dentro de las células. El efecto también fue reversible, y los niveles de colágeno volvieron a aumentar tras eliminarse los péptidos en un periodo de 48 horas.
Mejorar los resultados
Los autores observaron efectos similares en experimentos con fibroblastos de pacientes con esclerodermia, una enfermedad autoinmune compleja caracterizada por fibrosis de la piel y los órganos internos.
A continuación, los péptidos se probaron en el pez cebra, un modelo animal común para estudiar el desarrollo de tejidos y la cicatrización de heridas. La estrategia redujo visiblemente la deposición de colágeno en las áreas de la lesión.
El siguiente paso es evaluar la eficacia de los péptidos en la piel de cerdo porque se parece mucho a la humana
El siguiente paso es evaluar la eficacia de los péptidos en la piel de cerdo porque se parece mucho a la humana. También afinarán las propiedades de los péptidos para aumentar su potencia.
“Creemos que esto representa una nueva estrategia para controlar los efectos de la hipersecreción de colágeno. Podría ir desde aliviar los efectos cosméticos de las cicatrices de la piel hasta el tratamiento de enfermedades autoinmunes como la esclerodermia, así como la manipulación de los eventos relacionados con la cirugía asociados con la cicatrización de heridas para prevenir la fibrosis”, concluye Malhotra.
Referencia:
Raote et al. (2024) TANGO1 inhibitors reduce collagen secretion and limit tissue scarring. Nature Communications 2024
Derechos: Creative Commons.

